電気陰性度:洗浄化学の最重要知識(Q&A_013)
先に汚れの化学的な付着力について説明したが、その中で元素と元素の間の結合にファンデルワールス結合、水素結合、共有結合、イオン結合などの種々の種類があることを示した、汚れ落としの現象である洗浄を化学的に理解するうえで、これらの結合の仕組みを知ることは最重要だといっても過言ではない。また、そこで最も重要なのが「電気陰性度」について理解することである。
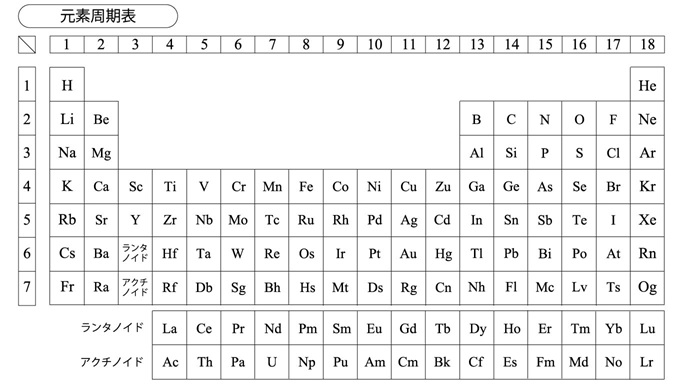
[元素周期表]
「水兵りーべ僕の船、なに間があるシップ・・・」の語呂で暗記した人もいるであろう元素の周期表(下図)がある。これは原子番号=陽子の数=電子の数が1つずつ増えて異なる元素になり、それらがある規則性をもって性質が変わっていくことを示す表である。電子は電子軌道に入っていくが、その軌道の状況によって安定さが変わってくる。周期表の右端一列は非常に安定な状態であり、そこから電子が少なくなる、あるいは多くなってくると電気的な中立性が損なわれることになる。周期表の右上が安定状態よりも電子が少ない状態で、他所から電子を奪ってこようとする力が強い。一方、周期表の左下に向かうと電子を引き付けておこうとする力が小さくなり、電子を他所に引き渡しやすくなる。
[電気陰性度とは?]
電子を他所から奪ってこようとする力の強さが電気陰性度(下図)である。電気陰性度の大きな元素の筆頭はフッ素(F)であり、その他に酸素(O)、塩素(Cl)、窒素(N)等も電気陰性度の大きな元素である。一方でカリウム(K)、カルシウム(Ca)、ナトリウム(Na)等は電気陰性度が小さい。下図の一番左側のF、Cl、Br、Iは第17族でハロゲン元素とよばれ、安定した状態の第18族よりも電子が一つ少ない。よって外部から電子を一つ奪って安定しようとする。そして電子を奪って陽子と電子の数が異なるのがイオンであり、第17族は電子が陽子よりも多くなるので陰イオンとなる。一方下図の一番左端は第1族で水素以外はアルカリ金属とよばれる元素である。アルカリ金属は第18族の安定した状態よりも電子が一つ多く、その電子は最外殻にある。アルカリ金属は最外殻の電子を引き付ける力が弱いので、電子を放出して陽イオンになりやす。このように、元素は周期的に性質が変化するが、その代表的な指標となるのが電気陰性度である。
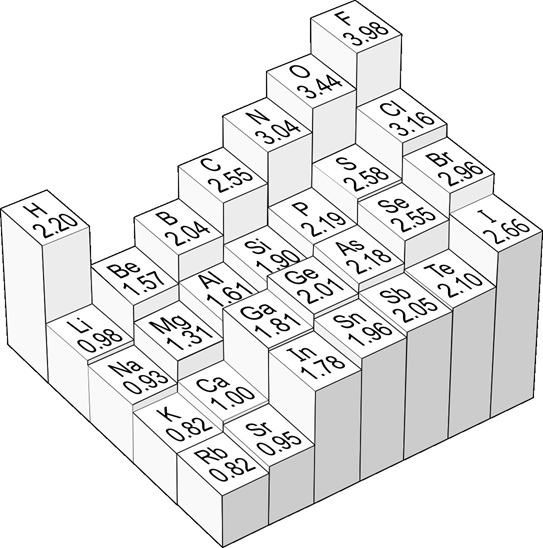
[電気陰性度と化学結合]
隣り合う元素の間の化学結合の大凡の傾向は電気陰性度で説明することができる。隣り合う元素の電気陰性度が同等か、大きく離れているか、若干離れているかで変化し、同等の場合は電気的偏りの小さい共有結合、大きく離れている場合はイオン結合、多少離れている場合は共有結合であるが電気的な偏りがある状態になる。
H2やO2など、同じ元素の原子が2つ結合した分子(等核二原子分子)は電気的な偏りのない共有結合となり、有機物の主体となる電気陰性度2.55の炭素(C)と電気陰性度2.20の水素(H)の間も電気陰性度の差が小さいので電気的偏りの少ない共有結合となる。食塩NaClは電気陰性度0.93のNaと電気陰性度3.16のClからなり、電気陰性度が大きく離れているためNaはClに電子を渡してNa+、Cl-のイオンとなる。水分子は電気陰性度3.44の酸素(O)と電気陰性度2.20の水素(H)の結合であるが、電気陰性度が大きくは離れていないので共有結合になるが程々には離れているので電気的な偏りのある共有結合となる。そして-OH基を含む分子は内部に電気的な偏りを有するので他の分子との間に水素結合やファンデルワールス結合の配向力の原因になる。
=====
横浜国立大学名誉教授 大矢 勝
oya@=@detergent.jp ←@=@を@に変えてください